ОЦЕНКА БУФЕРНЫХ СВОЙСТВ ФОСФАТОВ В СОСТАВЕ СРЕДЫ ДЛЯ КАПСУЛИРОВАНИЯ АЦИДОФИЛЬНОЙ ПАЛОЧКИ
Aннотация
Проведена оценка буферных свойств солей на основе ортофосфорной и полифосфорной кислот, входящих в состав инкапсулянта, по отношению к молочной кислоте, как основного продукта метаболизма пробиотических микроорганизмов рода Lactobacillus acidophilus. Показана степень эффективности выбранных солей на процесс регулирования кислотности инкапсулянта. Приведены данные по скорости проявления буферных свойств солей – гидроортофосфата натрия (Na2HPO4) и триполифосфата натрия (Na5P3O10) – в зависимости от концентрации образовавшейся молочной кислоты. Предложено теоретическое обоснование полученных зависимостей. Показано, что уровень снижения кислотности в значительной степени зависит от вида солей фосфорной кислоты. Высокая активность в проявлении буферных свойств наблюдалась при использовании триполифосфата натрия, и несколько сниженная при участии гидроортофосфата натрия. Установлено, что выбранные соли оказались хорошими регуляторами кислотности, но их присутствие в среде для капсулирования ацидофильной палочки ограничивается концентрацией 2%.
Ключевые слова: Буферные свойства, фосфаты, молочная кислота, ацидофильная палочка, кислотность, инкапсулянт
Введение. Понятие «функциональные продукты» возникло еще во второй половине ХХ столетия. По определению [4] «функциональный пищевой продукт» предназначен для систематического потребления в составе пищевых рационов всеми возрастными группами здорового населения. В документе также отмечено, что функциональные продукты способны снизить риск развития заболеваний, связанных с питанием, и являются эффективным профилактическим средством.
Особенным вниманием как производителей продуктов питания, так и потребителей пользуются «пробиотические продукты», т.е. содержащие в своем составе пробиотические микроорганизмы. Одним из важных представителей данного класса микробных культур являются бактерии вида Lactobacillus acidophilus, положительное действие которых на организм человека клинически доказано. Авторы приводят многочисленные примеры положительного влияния ацидофильной палочки на организм человека [9]. В дополнение к вышесказанному следует отметить, что ранее нами была изучена антагонистическая активность ацидофильной палочки по отношению к гнилостным бактериям, стрептококкам, стафилококкам, возбудителям брюшного тифа, паратифам А и В, дизентерийной, туберкулезной и дифтерийной палочкам, эшерихии коли и др. [2]. В работе [2] приведены результаты, наглядно доказывающие, что ацидофильная палочка действует угнетающе на образовавшиеся колонии патогенных и условно-патогенных микроорганизмов. Такое воздействие возникает на основании изучения метаболических свойств ацидофильной палочки [1]. Кроме того, улучшение работы иммунной системы [8] и желудочно-кишечного тракта [5, 10], как результат потребления ацидофильных продуктов, имеют достаточно неопровержимое клиническое подтверждение.
Ацидофильная палочка – неприхотливый к внешней среде, кислотоустойчивый, активно метаболизирующий пробиотический микроорганизм, оказывающий положительное воздействие на места ее природного обитания (толстый кишечник) и пути перемещения к нему (желудочно-кишечный тракт). Но существует и другая сторона вопроса, которая стала большой преградой на пути разработки продуктов с содержанием ацидофильной палочки. Высокая способность вырабатывать молочную кислоту приводит к тому, что уровень рН в основной среде, содержащей пробиотические микроорганизмы данного вида, быстро падает, что становится причиной крайне малых сроков хранения – приблизительно 72 часа. Такие сроки хранения не привлекают прозводителей и лишают возможности обеспечения полезными микроорганизмами большой части населения [3].
Решение данной проблемы лежит в плоскости создания капсулированных продуктов. Вовлечение в оболочку ацидофильной палочки позволит ограничить пространство ее существования и количество питательных веществ на ограниченной территории. Однако следует отметить, что уровень поддержания ацидофильной палочки в активной форме крайне необходим для реализации полной метаболической активности культуры при попадании в область ее природного заселения – толстый кишечник.
Цель работы – разработка состава среды для капсулирования, содержащего вещества, регулирующие изменения кислотности в ограниченном для существования ацидофильной палочки пространстве.
Материалы и методы исследования. В ходе исследований были использованы: молоко пастеризованное обезжиренное ДСТУ 2661:2010 (≤ 20 0Т, ρ ≥ 1,030 г/см3); вода питьевая дезаэрированная, очищенная; неорганические соли натрия (ч.д.а) (натрий однозамещенный ортофосфат и натрий триполифосфат (производитель ООО «Система Оптимум», Россия); камедь гуара (производитель ООО «Vianoc`S», Украина); молочная кислота (80%) (производитель ООО «Химстатус», Украина); закваска сухая из лиофилизированно высушеной культури Lactobacillus acidophilus штама LA-5 (производитель ООО «Хр. Хансен», Украина).
Экспериментальные и модельные экспериментальные образцы, содержащие буферные соли, были приготовлены на основании раствора гуаровой камеди – 0,8% с последующей пастеризацией в сушильном шкафу СП-50 (t = 95…98 оС, τ = (20…25)х60с) и охлаждением до t ≤ 55оС. В экспериментальные образцы после охлаждения при перемешивании были внесены пробиотические культуры (108 КОЕ/г).
Исследования колониеобразующей способности и морфологических признаков были проведены с использованием термостата и микроскопа лабораторных согласно ГОСТ 10444.11. В экспериментальных и модельных экспериментальных образцах кислотность измерялась ионометрическим методом с помощью рН-метра (СТ-6021А).
Вышеперечисленное оборудование и подобранные методики позволили в полной мере выполнить поставленные задачи и достичь цели исследования.
Результаты исследования и их обсуждение. Обязательными условиями капсулирования выступают следующие: присутствие структурообразующего вещества, каковым являются ионы кальция; среда, предназначенная для капсулирования, должна относиться к разряду вязко-текучей жидкости. Касательно соблюдения последнего условия, в качестве формирующего необходимые реологические характеристики среды, был выбран раствор гуаровой камеди (0,8%) предварительно пастеризованный.
Ранее был установлена предельно допустимая концентрация растворимых веществ в составе среды для капсулирования активных пробиотических микроорганизмов вида Lactobacillus acidophilus [1], которая составила 2,5%.
Исходя из вышеизложенной информации, а также с учетом того, что в среде должны самопроизвольно происходить процессы регуляция рН, вследствие накопления выработанной микроорганизмами молочной кислоты, были изучены физиологические и буферные свойства солей фосфорной кислоты различного химического состава [7]. По результатам исследования было установлено, что для пищевых продуктов, содержащих пробиотические микроорганизмы вида Lactobacillus acidophilus, целесообразным, с учетом всех условий, стало использование недозамещенных солей ортофосфорной кислоты и солей полифосфорной кислоты.
Недозамещенные соли фосфорной кислоты имеют достаточную буферную емкость в растворах с нерегулируемой кислотностью. Интересным стало изучение степени реализации буферных свойств одной из таких солей в растворах с повышенной вязкостью. В качестве солевой буферной составляющей был выбран дигидроортофосфат натрия (NaH2PO4). Исследования проводились в модельных средах без участия пробиотических микроорганизмов, а эффект их присутствия был воспроизведен за счет периодически добавляемого раствора молочной кислоты в количестве, которое вырабатывает данный штамм, находясь в среде для капсулирования в количестве не менее 108КОЕ/г. Результаты исследования приведены на рис. 1.
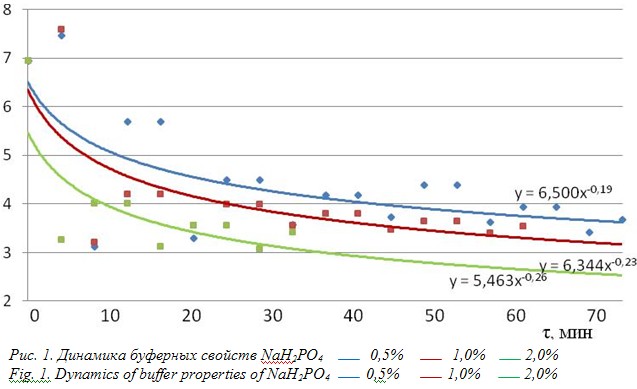
Зависимости, представленные на рис. 1, свидетельствуют о том, что на величину буферной емкости оказывает существенное влияние концентрация фосфата в среде. Согласно приведенным данным, наглядно видно, что достижение критических значений рН, находящихся в диапазоне (2,8…3,3), достигается быстрее при более высоких концентрациях фосфатов.
Для растворов солей 0,5%; 1,0% и 2,0% количество нейтрализованной кислоты соответствует следующим значениям: 5,7; 5,5; 4,4 ммоль. Следует отметить, что по отдельно взятым начальным точкам, где количество кислоты имеет небольшие значения, наибольшей буферной емкостью обладает раствор с содержанием соли 0,5%, а наименьшей – 2,0% раствор дигидроортофосфата.
В подобном аспекте представляет интерес рассмотреть в среде для капсулирования проявление буферных свойств натрий полифосфата. Данные приведены на рис. 2.
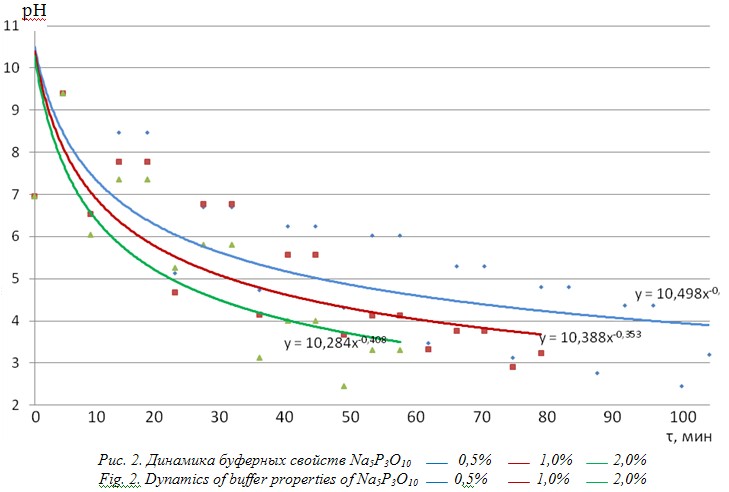
На рис. 2 наглядно видно, что проявление буферных свойств полифосфатов происходит более активно: с ростом концентрации натрий триполифосфата увеличивается количество нейтрализуемой кислоты. Для растворов с 0,5%; 1,0%; 2,0% оно соответствует 6,9; 9,7; 12,1ммоль. Как видно из рис. 2, максимальное значение рН достигает показателя 9,4, против 7,6, при рассмотрении модельных сред с участием дигидроортофосфатов. Это говорит о том, что полифосфатные соли гораздо более перспективны для решения вопроса пролонгации сроков хранения сред с ацидофильной палочкой. Однако необходимо учесть, что рН 9,4 может негативно влиять на жизнеспособность микроорганизмов в среде для капсулирования и в готовом продукте. Поэтому следует рассмотреть вариант совмещения недозамещенных ортофосфатов и полифосфатов в таком соотношении, при котором начальные рН не превышают значений 8,2…8,3.
На следующем этапе исследования во все вышепроанализированные среды были внесены пробиотические микроорганизмы в количестве 108КОЕ/г. Системы были термостатированы на 72 часа при t = 38 0С, после чего, по результатам количественного определения методом 10-тикратных разведений и последующего микроскопирования было установлено, что в средах с концентрацией 2,0% наблюдаются незначительные морфологические отклонения: в размерах 0,5…0,7×1,2…4,5 мкм; в форме и длине колоний.
Заключение. Рассмотренные в статье способы моделирования среды, предназначенной для капсулирования при участии солей, проявляющих буферные свойства, позволяют создать инкапсулянт с эффектом самонейтрализации, не нарушая при этом условий метаболизма и жизнедеятельности пробиотических микроорганизмов, и получить продукцию на основе ацидофильной палочки со сроками хранения, трижды превышающими существующие (10…12 суток). Однако следует рассмотреть вопрос о создании сред на основе смеси недозамещенных ортофосфатов и полифосфатов, которые на начальных стадиях нейтрализации молочной кислоты не допускали бы превышения значения рН 8,3.
















Список литературы