НАНОСТРУКТУРИРОВАННЫЕ ЭКСТРАКТЫ ЗЕЛЕНОГО ЧАЯ И ИХ СВОЙСТВА
Aннотация
Зеленый чай является источником ценных для организма человека соединений: фенолов, флавоноидов (катехинов), аминокислот, витаминов (B, C, E), ксантиновых оснований (кофеина, теофиллина), пигментов (хлорофилла, каротиноидов), летучих соединений, полисахаридов и микроэлементов (K, Mn, Cr, Ni и Zn). Флавоноиды чая способствуют профилактике ряда заболеваний: онкологических, сердечно-сосудистых, диабета и ожирения. Катехины зеленого чая могут также действовать как противоопухолевые средства. С учетом того, что физиологическая активность биологически активных соединений в значительной степени зависит от размера капсул, а в терапевтической эффективности флавоноидов важную роль может играть растворимость, целью данной работы являлось определение размеров и свойств наноструктурированного экстракта зеленого чая как перспективного наноингредиента пищевых продуктов функционального назначения. Исследования свойств наноструктурированного экстракта зеленого чая проводились с использованием методов КР-спектроскопии, сканирующей электронной микроскопии, самоорганизации и анализа траекторий наночастиц. В результате показано, что нанокапсулы, содержащие экстракт зеленого чая, проявляют супрамолекулярные свойства, способны растворяться в воде, а средний размер нанокапсул составляет от 148 до 331 нм. При этом размер нанокапсул экстракта зеленого чая существенно зависит от природы углеводной оболочки и соотношения ядро: оболочка. Так, при соотношении ядро: оболочка 1: 3 в альгинате и агар-агаре размер наночастиц составляет 157 нм, а в хитозане – 331 нм, а при соотношении ядро: оболочка 1 : 1 в хитозане размер наночастиц составлял уже 148 нм. Учитывая, что биоусвояемость биологически активных веществ зависит от размера частиц, можно полагать, что полученные наноструктурированные экстракты зеленого чая будут обладать лучшей биоусвояемостью и могут использоваться в качестве наноингредиентов в функциональных продуктах питания.
Ключевые слова: нанокапсулы, экстракт зеленого чая, самосборка, метод анализа траекто-рий наночастиц, сканирующая электронная микроскопия
Введение. Химический состав зеленого чая достаточно изучен, и ему придается большое значение в смысле лечебного воздействия на организм. Зеленый чай содержит много ценных для организма человека соединений, таких как фенолы, флавоноиды (катехины), аминокислоты, витамины (B, C, E), ксантиновые основания (кофеин, теофиллин), пигменты (хлорофилл, каротиноиды) и летучие соединения (альдегиды, спирты, эфиры, лактоны, углеводороды) (Armoskaite and other, 2011). Помимо перечисленных соединений, чай является диетическим источником полисахаридов и микроэлементов, таких как K, Mn, Cr, Ni и Zn (Komes, 2010). Благоприятное воздействие зеленого чая на организм связывают в основном с содержанием в нем полифенолов, особенно флаванонов и флавонолов, составляющих 30% сухого веса свежих листьев (Naghma, Hasan, 2007). В его составе присутствует группа соединений, способных обеспечить антиоксидантную защиту организма, – эпигаллокатехин-3-галлат (ЭГКГ), полифенон-60, эпикатехин-3 галлат и др. В зеленом чае обнаружено порядка 12 катехинов, из которых 59% приходится на долю эпигаллокатехин 3-галлата (ЭГКГ). Многочисленные эпидемиологические исследования доказывают, что флавоноиды чая способствуют профилактике онкологических и сердечно-сосудистых заболеваний, диабета и ожирения (Prathapan and other, 2011; Vuong and other, 2011). Катехины зеленого чая могут также действовать как противоопухолевые средства (Roomi and other, 2005). Известно также, что флавоноиды чая влияют на качество и стабильность пищевых продуктов, действуя как ароматизаторы, красители и антиоксиданты (Kumar and other, 2012), предотвращая перекисное окисление липидов, помогая решать серьезную проблему пищевой промышленности, – возникновение прогорклости и потенциальной токсичности продуктов (Vuong and other, 2011). Физиологическая активность биологически активных соединений в значительной степени зависит от размера капсул (McNeil, 2005). Результаты исследования многих лекарственных веществ показывают, что с уменьшением размеров капсул усиливается их биодоступность и эффективность (Bogunia-Kubik and other, 2002). Следовательно, повысить биодоступность можно путем уменьшения частиц ингредиента до микро- и наноразмеров (Mathiowitz and other, 1997). Важную роль в терапевтической эффективности флавоноидов играет их растворимость. Низкая растворимость флавоноидов в воде часто представляет собой проблему для их применения в медицине (Shashank, Abhay, 2013). В ряде работ обсуждаются методы получения и исследования физиологической активности антиоксидантов (Кролевец, Быковская, Тырсин, 2015; Кролевец, Тырсин, Воронцова, 2015). Однако свойства различных биологически активных веществ наноуровня, в частности, наноструктурированного экстракта зеленого чая, не изучены, и рассматриваются нами впервые.
Основная часть. Цель исследований – определение свойств наноструктурированного экстракта зеленого чая как перспективного наноингредиента пищевых продуктов функционального назначения.
Материалы и методы исследования. Материалами исследования являлись образцы наноструктурированных экстрактов зеленого чая в различных углеводных оболочках. КР-спектры определялись на дисперсионном микроспектрометре комбинационного рассеяния (Раман) серии NRS-5000 фирмы JASCO. Исследования проведены на сканирующем электронном микроскопе – Quanta 250 FEG. Для исследования самоорганизации нанокапсул порошок наноструктурированного зеленого чая растворяли в воде. Оптимальным разведением было выбрано соотношение исследуемого порошка наноструктурированного чая и воды 1 : 100. Каплю исследуемого образца наносили на покровное стекло и выпаривали. Высушенную поверхность сканировали методом конфокальной микроскопии на микроспектрометре OmegaScope производства AIST-NT (г. Зеленоград), совмещенном с конфокальным микроскопом. Определение размера нанокапсул методом анализа траекторий наночастиц проводили на мультипараметрическом анализаторе наночастиц Nanosight LM0 производства Nanosight Ltd (Великобритания) в конфигурации HS-BF (высокочувствительная видеокамера Andor Luca, полупроводниковый лазер с длиной волны 405 нм и мощностью 45 мВт). Работа прибора основана на методе анализа траекторий наночастиц (Nanoparticle Tracking Analysis, NTA), описанном в ASTM E2834. Для измерения были выбраны параметры прибора: Camera Level = 16, Detection Threshold = 10 (multi), Min Track Length: Auto, Min Expected Size: Auto, длительность единичного измерения 215 с, использование шприцевого насоса.
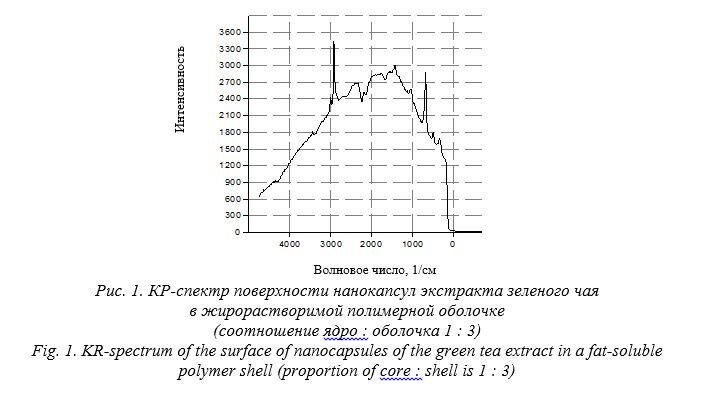
Результаты исследования и их обсуждение. Были исследованы КР-спектры нанокапсул экстракта зеленого чая в жирорастворимой полимерной оболочке (рис. 1).
В спектре комбинационного рассеяния поверхности нанокапсул экстракта зеленого чая в хитозане во всех соотношениях найдены линии, характерные для данной полимерной оболочки: 2921 см-1 – связи –СН2; 1452 см-1 – связи –СН; 1291 см-1 – связи –ОН. Супрамолекулярные свойства определяли с помощью процесса самоорганизации (процесс упорядочения элементов одного уровня в системе за счет внутренних факторов, без внешнего специфического воздействия) по описанной ранее методике (Кролевец, Быковская, 2012; Кролевец, Богачев, 2015). Результаты приведены на рис. 2.
в) in konjac gum in a concentration of 0.125%, an increase of 930 times
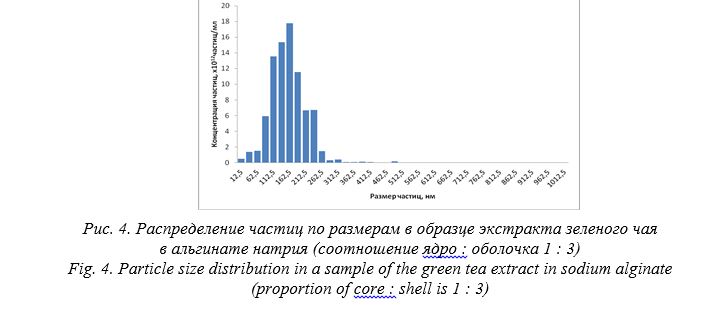
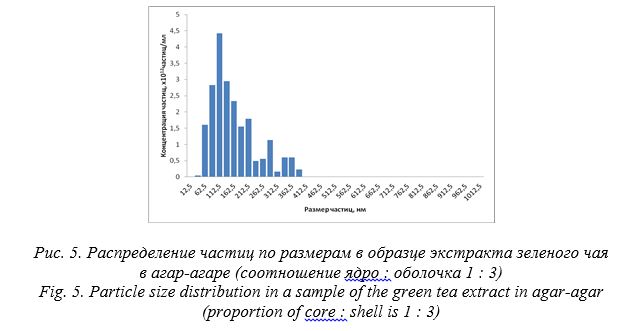
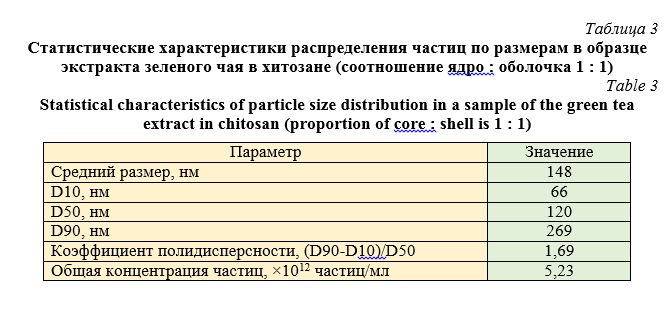
На рис. 2 представлены самоподобные объекты, инвариантные относительно локальных дилатаций, т. е. фракталы. Известно, что фракталы являются естественным заполнением множеств между известными евклидовыми объектами с целочисленными размерностями. Наличие фрактала указывает на возможность получения совершенно другого полимера при практически неизменном составе макромолекулы. Этот «новый полимер» будет иметь другие молекулярные характеристики и отличающуюся надсегментальную структуру. Фрактальная композиция также указывает на процесс самосборки и образования нанокапсул. Поскольку при достаточно низкой концентрации (0,125%) нанокапсул в водном растворе обнаружены фрактальные композиции, это доказывает, что они обладают самоорганизацией. Образование нанокапсул происходит спонтанно за счет нековалентных взаимодействий, подтверждая, что для них характерны процессы самосборки. Следовательно, наноструктурированные экстракты зеленого чая обладают супрамолекулярными свойствами. Данные исследований наноструктурированного экстракта зеленого чая методом СЭМ представлены на рис. 3. Необходимо отметить, что результаты, полученные методом сканирующей электронной микроскопии (СЭМ) и методом анализа траекторий наночастиц (рис. 4-7, табл. 1-4), противоположны. Это объясняется тем, что методом СЭМ анализировались капсулы экстракта зеленого чая в порошкообразном состоянии, а методом анализа траекторий наночастиц – в растворе при большом разбавлении.
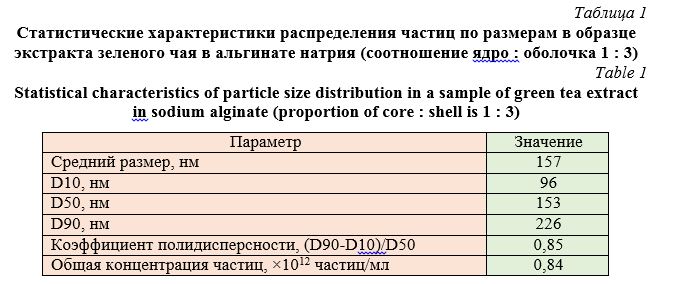
Полидисперсность материала – это неоднородность частиц по крупности или разнофракционность. Коэффициент полидисперсности kd зависит от средневзвешенной крупности материала. Полидисперсность материала также зависит от медианного диаметра частиц в распределении. Таким образом, наиболее однородными являются частицы, средневзвешенная крупность которых близка к медианному диаметру, что подтверждают данные, приведенные в табл. 1-4.
Полученные результаты показывают, что размер нанокапсул экстракта зеленого чая существенно зависит от природы углеводной оболочки. Так, при массовом соотношении ядро : оболочка 1 : 3 наименьший размер – 157 нм – в альгинате натрия, наибольший – 331 нм – в хитозане. При этом, при использовании одной оболочки (хитозан), но при уменьшении массового соотношения ядро : оболочка от 1 : 3 до 1 : 1 размер частиц уменьшается с 331 нм до 148 нм.
Заключение. В результате проведенных исследований установлено, что нанокапсулы, содержащие экстракт зеленого чая, проявляют супрамолекулярные свойства, способны к самосборке, хорошо растворяются в воде, а средний размер нанокапсул, в зависимости от природы углеводной оболочки, составляет от 148 до 331 нм. Полученные наноструктурированные экстракты зеленого чая, учитывая размеры нанокапсул, будут обладать хорошей биоусвояемостью и могут быть рекомендованы для использования в качестве наноингредиентов в функциональных продуктах питания.
Информация о конфликте интересов: автор не имеет конфликта интересов для декларации.
Conflicts of Interest: author have no conflict of interests to declare.






















Список литературы
1. Кролевец, А. А., Быковская, Е. Е. Исследование супрамолекулярных свойств микрокапсул цефазолина // Применение инновационных технологий в научных исследованиях : сб. науч. статей по материалам IV Международной науч.-практ. конф. / ГОУ ВПО «Юго-Зап. гос. ун-т». Курск. 2012. С. 343-348.
2. Кролевец, А. А., Богачев, И. А. Самоорганизация нанокапсул бетулина // Национальная ассоциация ученых. 2015.
№ 2-9 (7). С. 152-156.
3. Пат. № 2560664 Российская Федерация, МПК А 61 К 31/352, А 61 К 9/50, А 61 К 47/36, А 61 J 3/07, B 01 J 13/02. Способ получения микрокапсул антиоксиданта с оболочкой из альгината натрия / Кролевец А. А., Быковская Е. Е., Тырсин Ю. А., Воронцова М. Л.; заявитель и патентообладатель Кролевец А. А., Быковская Е. Е., Тырсин Ю. А., Воронцова М. Л. –
№ 2013131724/15; заявл. 09.07.2013; опубл. 20.08.2015, Бюл. №23.
4. Пат. № 2566710 Российская Федерация, МПК А 61 К 36/185, А 61 К 47/36, А 61 К 9/50, А 61 J 3/07. Способ получения микрокапсул антиоксидантов, обладающих супрамолекулярными свойствами / Кролевец, А. А., Тырсин, Ю. А., Воронцова, М. Л.; заявитель и патентообладатель Кролевец А. А., Тырсин Ю. А., Воронцова М. Л. – № 20131314119/15; заявл. 19.07.2013; опубл. 27.10.2015, Бюл. №30.
5. The analysis of quality and antioxidant activity of green tea extracts / V. Armoskaite, K. Ramanaukiene, A. Maruska, A. Razukas, A. Dagilyte, A. Baranuskas, V. Bredis // Journal of Medicinal Plants Research. 2011. Vol. 5(5). Pp. 811-816.
6. Bogunia-Kubik, K., Sugisaka, M. From molecular biology to nanotechnology and nanomedicine // Biosystems. 2002.
Vol. 65(2-3). Pр. 123-138.
7. Green tea preparation and its influence on the content of bioactive compounds / Komes D., Horzic D., Belscak-Cvitanovic A., Ganić K. K., Vulić I. // Food Research International. 2010. Vol. 43. No. 1. P. 167-176.
8. Protective efficacy of Solanum xanthocarpumroot extracts against free radical damage: phytochemical analysis and antioxidant effect / Kumar S., Sharma U. K., Sharma A. K., Pandey A. K. // Cellular and Molecular Biology. 2012. Vol. 58. No. 1. Pр. 171-178.
9. Biologically erodable microspheres as potential oral drug delivery systems / Mathiowitz E., Jacob J. S., Jong Y. S., Carino G. P., Chickering D. E., Chaturvedi P., Santos C. A., Vijayaraghavan K., Montgomery S., Bassett M., Morrell C. // Nature. 1997.
No. 386(6623). Pр. 410-414.
10. McNeil, S. E. Nanotechnology for the biologist // Journal of Leukocyte Biology. 2005. Vol. 78 (3). Pp. 585-594.
11. Naghma, K., Hasan, M. Tea polyphenols for health promotion // Life Sciences. 2007. Vol. 81. No. 7. Pр. 519-533.
12. Antiperoxidative, free radical scavenging and metal chelating activities of Boerhaavia Diffusa L. / Prathapan A., Singh M. K., Anusree S. S., Soban Kumar D. R., Sundaresan A., Raghu K. G. // Journal of Food Biochemistry. 2011. Vol. 35. No. 5. Pр. 1548-1554.
13. In vitro and in vivo antitumorigenic activity of a mixture of lysine, proline, ascorbic acid, and green tea extract on human breast cancer lines MDA-MB-231 and MCF-7 / Roomi M. W., Ivanov V., Kalinovsky T., Niedzwiecki A., RathIn M. // Medical Oncology. 2005. Vol. 22. No. 2. Pр. 129-138.
14. Shashank Kumar, Abhay K. Pandey Chemistry and Biological Activities of Flavonoids: An Overview // The Scientific World Journal, 2013. Vol. 2013 (2013), Article ID 162750, 16 p. URL: http://dx.doi.org/10.1155/2013/162750.
15. Production of caffeinated and decaffeinated green tea catechin powders from underutilized old tea leaves / Vuong V. Q., Golding B. J., Nguyen H. M., Roach D. P. // Journal of Food Engineering. 2011. Vol. 110. Pр. 1-8.