ИССЛЕДОВАНИЕ КАЧЕСТВЕННОГО И КОЛИЧЕСТВЕННОГО СОСТАВА ФЕНОЛЬНЫХ СОЕДИНЕНИЙ ЧЕРНИКИ (VACCINIUM MYRTILLUS L.) КАК СЫРЬЯ ДЛЯ ПИЩЕВОЙ И ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ
Aннотация
Черника традиционно используется как сырье в пищевой и фармацевтической промышленности. Регулярное употребление этих ягод уменьшает количество хронических заболеваний благодаря высокому содержанию полифенолов. В настоящем исследовании спектрофотометрический метод использован для количественного определения общего количества полифенолов в чернике и метод HPLC для идентификации и определения некоторых фенольных соединений. В результате были обнаружены галловая, сиреневая, коричная, кофейная, феруловая и хлорогеновая кислоты, ресвератрол, катехин, рутин и кверцетин. Установлено, что из выделенных идентифицированных фенольных соединений хлорогеновая кислота находится в наибольшей концентрации – 85,42 мг/100 г растительного продукта, а ресвератрол в наименьшей концентрации – 0,25 мг/100 г растительного продукта.
Введение. На национальном и международном уровне в настоящее время отмечается повышенное внимание к применению лесных ягод. Исследование натуральных химических соединений растительных продуктов является важной темой современной химии, которая не прекращает привлекать во многих странах живой интерес, как теоретический, так и практический.
Для полноценного использования лесных ягод необходимо использование современных методов экстракции и очистки, изучение содержания биологически активных веществ в растительных материалах, их локализация на уровне органов и тканей, а также наиболее эффективное применение этих соединений в различных областях деятельности, например, в пищевой или фармацевтической промышленности.
Черника (Vaccinium myrtillus L.) – это лесная ягода, традиционно используемая в Европе в питании и как медицинский продукт [12]. Вследствие накопления большого числа биологически активных веществ, макронутриентов и микронутриентов она обладает рядом функциональных свойств. В первую очередь это обусловлено антиоксидантной активностью биологически активных веществ, способных нейтрализовать свободные радикалы [7]. Среди биологически активных веществ с сильными антиоксидантными свойствами присутствуют полифенолы, в первую очередь антоцианы [3]. Это – ответственные за красный, голубой или фиолетовый цвет поверхности фруктов, семян, цветов и некоторых листьев красящие вещества, обладающие рядом положительных биологических эффектов [6], как и некоторые другие компоненты растительных источников – каротиноиды, токоферолы, микроэлементы, полиненасыщенные жирные кислоты [11]. Синтез полифенолов в клетках животных и человека невозможен, поэтому они поступают в организм преимущественно с растительной пищей, оказывая при этом на него в целом благоприятное воздействие.
Лесные ягоды, например черника, ежевика и клюква, богаты полифенольными соединениями (флавоноидами); это, в первую очередь, антоцианы, флавоны, флаванолы, проантоцианиды, фенольные кислоты (гидроксибензойные и гидроксикоричные) и элагитанины, которые накапливаются в различных концентрациях в зависимости от внутренних (генетических) факторов, а также от окружающей среды [5]. Черника является одной из ягод с повышенной антиоксидантной активностью, благодаря присутствию фенольных соединений в значительных количествах [8]. Она имеет антиокислительные, сосудозащитные, противодерматитные и противовоспалительные свойства. Черника используется в основном в офтальмологии, а также как вспомогательное средство при лечении заболеваний сосудов, например, капиллярной хрупкости, венозной недостаточности или геморроя [9].
Исследования показали, что регулярное потребление лесных ягод может уменьшить риск появления некоторых хронических заболеваний, например, сердечно-сосудистых, раковых, легочных заболеваний, артрита или диабета. Также был доказан и их омолаживающий эффект [8].
Антиоксиданты известны как важные биологически активные вещества, оказывающие положительное влияние на здоровье. Они широко используются в пищевой промышленности как потенциальные ингибиторы окисления липидов [10]. По этой причине внимание ученых направлено на натуральные, нетоксичные антиоксиданты, защищающие человеческий организм от воздействия свободных радикалов, которые могут обусловливать появление хронических дегенеративных заболеваний.
Учитывая известные свойства черники, в настоящей работе была поставлена цель экстрагировать, отделить и идентифицировать полифенольные соединения этих лесных ягод.
Материалы и методы.
Подготовка пробы. Черника была собрана в окрестностях г. Сибиу (Румыния), заморожена и хранилась при температуре -20ºC. Для проведения анализов ягоды высушивались при 50ºC в свободном потоке теплого воздуха.
500 мг порошка растительного продукта подвергали экстракции в 10 мл растворителя: метанол/вода в пропорции 70:30 (V/V). Экстракция проводилась в колбе Эрленмейера, закрытой шлифованной пробкой. Колбу выдерживали в ультразвуковой ванне в течение 30 мин. при температуре 40ºC. Смесь центрифугировали при 5000 об/мин в течение 10 мин. и полученный экстракт декантировали с осадка и высушивали. Сухой остаток растворяли в 10 мл растворителя, фильтровали и доводили до объема 10 мл этим же растворителем.
Анализ общих полифенолов. Спектрофотометрический анализ общих полифенолов проводили по методу Фолина-Чокальтеу, адаптированному по действующему изданию Европейской Фармакопеи 8.0.
К 1 мл анализируемого раствора, разбавленного в соотношении 1:10, добавляли 1 мл реактива Фолина, 15 мл дистиллированной воды и 2 мл раствора карбоната натрия 290 г/л. Приготовленную смесь встряхивали 10 минут, затем выдерживали в водяной бане при температуре 40 ºC в течение 20 минут. Раствор охлаждали и измеряли оптическую плотность полученного раствора при 760 нм.
Пересчет выполняли на галловую кислоту по калибровочной кривой, которую строили, в аналогичных условиях, заменяя анализируемый раствор на раствор галловой кислоты различной концентрации в метаноле. Растворы галловой кислоты готовились следующим образом. В 5 мерных колб объемом 25 мл вводили соответственно 1, 2, 3, 4 и 5 мл раствора галловой кислоты 1 мг/мл и доводили до метки метанолом. Полученные растворы обрабатываются аналогично анализируемой пробе. Концентрацию общих полифенолов в анализируемой пробе выражали в мг галловой кислоты на 100 мг растительного продукта.
Анализ некоторых фенольных соединений. Качественный и количественный анализ проводился методом высокоэффективной жидкостной хроматографии с использованием хроматографической колонки 250×4,6 мм Zorbax Eclipse Plus C18, 5 мкм при температуре термостата колонок 25 ºC. Элюирование проводилось в градиентном режиме с использованием трех растворителей: А – дистиллированная вода степени очистки Milli-Q, В – абсолютный метанол и С – смесь очищенной воды и ледяной уксусной кислоты в пропорции 96:4 (по объему). Программа градиента: 0 мин: 15% В и 85% С, 15 мин – 75% А и 25% В, 20 мин: 15% А и 85% В, 40 мин: 40% А и 60% В, 45 мин: 5% А и 95% В, 55 мин: 5% A и 95% B, 60 мин: 85% A и 15% B и 70 мин: 85% A и 15% B. При этом скорость подачи элюента составляла: 0 мин: 0.5 мл/мин. и от 15 до 70 мин: 0,8 мл/мин. Объем вводимой пробы 5 мкл. Детектирование осуществляли при 280, 303, 330 и 360 нм; указанные длины волн были предварительно выбраны по спектрофотометрическим параметрам определяемых компонентов [4].
Результаты и обсуждение. В чернике было обнаружено общее количество полифенольных соединений – 56,31 мг/100 мг растительного продукта (в пересчете на галловую кислоту). Результат был получен с использованием калибровочной кривой, представленной на рис. 1, и пересчитан на 100 мг исходного растительного продукта.
Рис. 1.Калибровочная кривая общих полифенолов в методе Фолина-Чокальтеу
Fig. 1. Total polyphenols the calibration curve in the method Polina-Ciocalteu
Эти результаты указывают на общее количество присутствовавших в экстракте полифенолов, чувствительных к реактиву Фолина-Чокальтеу.
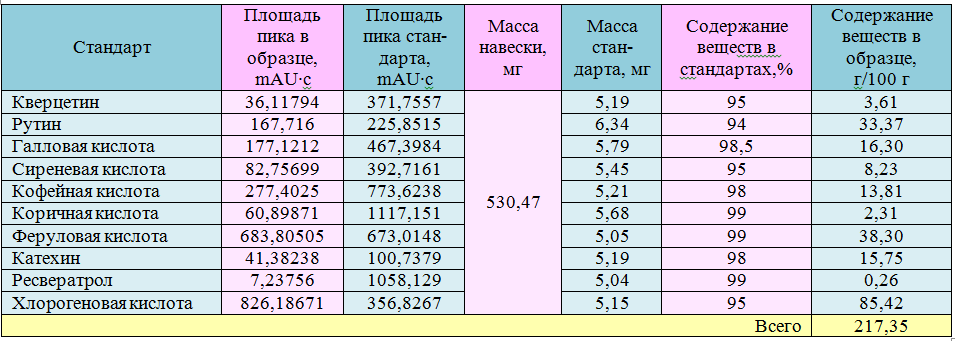
Путем использования метода ВЭЖХ были получены иные результаты: общее количество фенольных веществ было определено в количестве 217,35 мг/100 г растительного продукта. При этом вещества определяли при длинах волн, соответствующих максимумам абсорбции соединений: при 280 нм детектировали галловую кислоту, (+)-катехин, сиреневую и коричную кислоты, при 303 нм – ресвератрол, при 330 нм хлорогеновую, кофейную и феруловую кислоты, а при 360 нм – рутин и кверцетин (рис. 2, 3).
Рис. 2.Хроматограмма смеси стандартов фенольных соединений: A – 280 nm, B – 303 nm, C – 330 nm, D – 360 nm
1 – галловая кислота, 2 – (+)-катехин, 3 – сиреневая кислота, 4 – коричная кислота, 5 – ресвератрол, 6 – хлорогеновая кислота, 7 – кофейная кислота, 8 – феруловая кислота, 9 – рутин, 10 –кверцетин
Fig. 2. Chromatogram of mixture of standards of phenolic compounds:A – 280 nm, B – nm 303, C – 330 nm, D – 360 nm
1 – gallic acid, 2 – (+)-catechin, 3 – lilac acid, 4 – cinnamic acid, 5 – resveratrol, 6 – chlorogenic acid, 7 – coffee acid, 8 – ferulic acid, 9 – rutin, 10 – quercetin
Рис. 3.Хроматограмма фенольных компонентов экстракта черники Запись экстракта при: A – 280 нм, B – 303 нм,
C – 330 нм, D – 360 нм 1 – галловая кислота, 2 – (+)-катехин, 3 – сиреневая кислота, 4 – коричная кислота, 5 – ресвератрол, 6 – хлорогеновая кислота, 7 – кофейная кислота, 8 – феруловая кислота, 9 –рутин, 10 –кверцетин
Fig. 3. Chromatogram of the phenolic components of blueberry extract Record extract at A – 280 nm, B – nm 303, C – 330 nm, D – 360 nm 1 – gallic acid, 2 – (+)-catechin, 3 – lilac acid, 4 – cinnamic acid, 5 – resveratrol, 6 – chlorogenic acid, 7 – coffee acid, 8 – ferulic acid, 9 – rutin, 10 – quercetin
Идентификация фенольных соединений проводилась путем сравнения времен удерживания (табл. 1) фенольных соединений в смеси стандартов (рис. 2) с веществами из экстракта черники (рис. 3). Для количественных расчетов использовали площади пиков и градуировочные зависимости, построенные по стандартным веществам.
Таблица 1
Время удержания фенольных соединений
Table 1
The retention time of phenolic compounds

Наибольшее количество из определенных в экстрате веществ пришлось на хлорогеновую кислоту 85,42 мг /100 г, затем следует феруловая кислота и рутин, содержание которых составило, соответственно 38,30 мг /100 г и 33,37 мг/100 г. Галловая кислота, (+)-катехин и кофейная кислота найдены в количестве между 10 и 20 мг/100 г. Наименьшим оказалось содержание в растительном продукте кверцетина, сиреневой и коричной кислот и ресвератрола. Последний находится в количестве менее 1 мл/100 г (табл. 2).
Таблица 2
Количественный анализ фенольных соединений
Table 2
Quantitative analysis of phenolic compounds
Выводы. Исследования последних лет отмечают способность черники снижать риск возникновения определенных хронических заболеваний. Это можно объяснить значительным количеством полифенольных соединений, содержащихся в этих ягодах. Количество таких соединений в чернике, собранной в окрестностях г. Сибиу (Румыния), было определено спектрофотометрическим методом с использованием реактива Фолина-Чокальтеу, и было выражено в эквивалентах галловой кислоты в мг на 100 г продукта. В чернике было найдено 56,31 мг полифенолов на 100 г растительного продукта.
Качественный и количественный анализ фенольных соединений, выполненный методом ВЭЖХ, показал, что в этих ягодах имеется значительное количество хлорогеновой кислоты, феруловой кислоты и рутина. Меньше всего в чернике обнаружено сиреневой кислоты, ресвератрола и кверцетина.
















Список литературы
J. Coreea-Betanzo, G. Paliyath, // Encyclopedia of Food and Health, Reference Module in Food Science, 2016.
Рр. 364-371.
R. Scherer, H. T. Godoy // Food chemistry № 112. 2009. Рр. 654-658.
Рр. 83-99.